|
研究の背景:Duchenne型筋ジストロフィー(DMD)は、小児期発症の最も頻度の高い遺伝性筋疾患で、致死性の進行性の筋萎縮を呈し20歳台に死亡する。DMDは、DMD遺伝子の異常により、骨格筋でジストロフィンタンパクが欠損し発症する。受賞者は、mRNA編集技術により患者の遺伝子機能を回復させ、ジストロフィンを発現させる治療を提唱した。
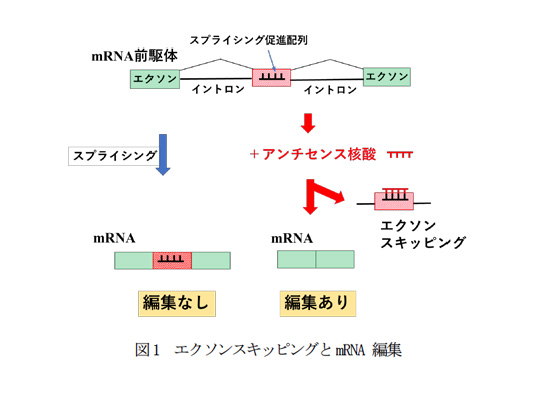
研究技術の概要:この技術は、アンチセンス核酸(ASO)を用いてスプライシング促進配列の機能を阻害し、DMD遺伝子のエクソンのスキッピングを誘導し、mRNAを編集する(図1)。遺伝子から産生されるmRNA前駆体はエクソンとイントロンの配列からなっている。mRNA前駆体はスプライシングを受け、エクソン配列のみからなるmRNAとなる。このスプライシング反応時に、エクソン内のスプライシング促進配列に相補的なアンチセンス核酸(ASO)を導入する。すると、スプライシング促進配列の機能が阻害されエクソンのスキッピングが誘導され、エクソンの配列が消失した新たなmRNAを産生する。
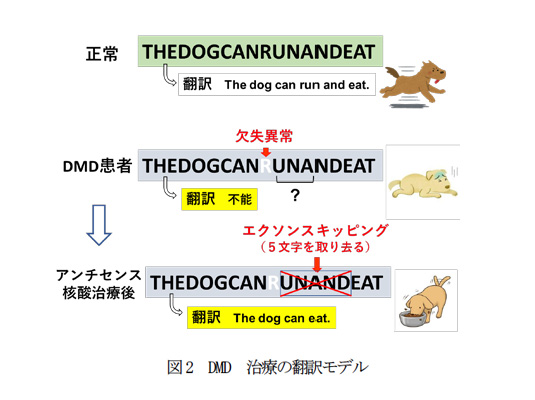
特徴と効果/実績:mRNA編集によりDMD mRNAのアミノ酸読み取り枠をタンパクへの翻訳が可能な形へ変換し、DMD患者の遺伝子からジストロフィンを発現させることを特徴としている。DMDではエクソンの欠失の遺伝子異常によりmRNAのアミノ酸読み取り枠がずれ、タンパクへ翻訳ができない(図2)。この欠陥mRNAからエクソンスキッピングによりエクソンの配列を取り除き、アミノ酸読み取り枠を回復させると翻訳が可能となりストロフィンが産生される。受賞者は、この技術の有効性を世界に先駆けて示し,未開拓領域の扉を開いた。受賞者が開発したアンチセンス核酸は、現在第一三共(株)によりフェーズ I/IIの臨床治験中である。一方、本技術が最有力のDMD治療法として世界的な研究の勃興を導き、2016年にアメリカにおいてモルフォリノアンチセンス核酸の承認薬を産み出した。また、本技術は、遺伝子機能の回復にとどまらず遺伝子機能の阻害にも応用され、広く遺伝子機能操作法として普及している。
|


















